Neurophysiology of Vestibular Compensation
Article information
Abstract
Vestibular compensation is the process by which patients achieve functional recovery after vestibular lesions, and can be divided into static compensation and dynamic compensation. The first stage, static static compensation, consists of eliminating static symptoms (i.e., spontaneous nystagmus and skew deviation) by rebalancing the tonic neural activity in the vestibular nuclei. The second stage, dynamic compensation is much more subtle, takes longer, and involves a central recalibration of the response properties of the vestibulo-ocular reflex (VOR) (i.e., timing and gain) in order to restore the compensatory actions of the VOR to pre-impairment levels. This review is to introduce the normal vestibular function in humans to understand the neurophysiology of vestibular compensation after vestibular lesions, and to review the effects of various types of lesions and the clinical findings in various stages of compensation after each type of lesion. Vestibular compensation is most effective for unilateral vestibular dysfunctions in which tonic neural activity of the vestibular nucleus is rebalanced to achieve static compensation. Adaptive changes in tonic neural activity occur in the normal vestibular pathways to achieve dynamic compensation. In other types of vestibular lesions, vestibular compensation is possible, but not as effective.
INTRODUCTION
말초성 전정 이상은 감각 및 운동 기전의 기능에 모두 영향을 미치며 다양한 증상을 유발한다. 이러한 증상은 크게 두 가지 유형으로 구분할 수 있다(Halmagyi et al., 2010). 첫째, 정적 증상(static symptom)은 머리를 움직이지 않는 정지 상태에서도 발현되는 증상이다. 정적 증상은 갑작스러운 일측성 전정기능 손실과 관련되어 있으며, 일반적으로 현훈, 불균형감, 메스꺼움, 구토 등이 포함된다. 둘째, 동적 증상(dynamic symptom)은 머리나 몸 전체를 움직일 경우에 한해 나타나는 증상이다. 동적 증상은 종종 전정기능 손실이 시작된 직후에 나타나며, 시야 흐림, 시력 손실, 복잡한 감각 환경에서 머리를 움직일 경우 방향 감각 상실을 포함한다. 예를 들어, 양측 말초 전정계가 모두 정상이던 사람이 한쪽 말초 전정계의 기능을 갑자기 손실하게 되면 다음과 뚜렷한 패턴의 증상을 나타내게 된다. 첫째, 환자는 전체 환경이 자신을 중심으로 회전하고 있거나 자신이 환경 내부를 회전하고 있는 것으로 정의되는 “진정한” 현훈(vertigo)을 호소한다. 이러한 환자들은 메스꺼움(오심)과 구토를 경험한다고 묘사할 수도 있다. 둘째, 환자의 전정기능이 급성으로 손상된 경우, 주로 빠른 위상이 병측 반대 방향으로 향하는 선형적인 속도의 수평 안진을 나타낸다. 이러한 안진은 일반적으로 시고정을 하지 않은 경우 강화된다. 셋째, 환자는 병변측으로 넘어지는 등의 자세 장애를 보이거나, 똑바로 걷는 데 어려움을 겪거나 조명이 약한 환경에서 매우 불안정하다고 불평할 수 있다. 논쟁의 여지가 있지만, 신경학적으로 정상인 사람에서 이러한 증상은 꽤 오랜 시간(3개월~1년) 후 회복된다(Lacour et al., 2016). 현훈이 멈춘 후에도 환자는 머리를 빠르게 움직일 때 여전히 이상함을 느낀다고 호소할 수 있지만, 일반적으로 어지럼증 발생 전의 생활 방식으로 되돌아 갈 수 있다. 이와 같이, 전정 증상은 점점 완화되며, 전정 손실이 영구적인 경우에도 대부분의 환자에서 결국 사라진다.
말초성 전정 병변(말단 전정기관 및 전정신경) 발병 후 이러한 기능적 회복 과정을 전정 보상(vestibular compensation)이라고 하며, 중추 전정경로 내의 높은 가소성(plasticity)과 관련이 있다(Curthoys & Halmagyi, 1995; Tighilet et al., 2019). 그러나 전정 보상을 병변의 치유 및 정상적인 전정기능의 회복으로 인해 발생하는 완전 회복으로 오인해서는 안 된다(Manzari et al., 2013).
인간과 동물을 대상으로 세포, 신경, 행동학적 측면에서의 전정 보상이 광범위하게 연구되었다(Chen et al., 2019; Cullen et al., 2009; Lacour et al., 2016). 이러한 연구는 전정 질환의 시간 경과에 대한 더 나은 이해와 전정 병변 후 빠른 회복을 위한 효과적인 재활 프로토콜을 고안하는 데 기초를 제공하였다. 그러나 전정 보상 과정에 대한 우리의 이해에는 상당한 격차가 남아 있다. 예를 들어, 전정 보상에 대한 대부분의 연구는 전정안반사(vestibulo-ocular reflex, VOR)의 기능적 회복과 주로 수평 및 수직 반고리관 VOR의 회복에 중점을 두었다(Cremer et al., 1998; Sjögren et al., 2018). 최근에는 이석 경로의 단독 병변 이후 전정 보상을 다룬 연구도 진행되고 있으나(Baier et al., 2022; Mbongo et al., 2005) 관련 연구가 부족한 실정이다. 마찬가지로, 인간의 자세조절 결함에 대한 보상 과정은 주로 신경 또는 세포 측면에서의 회복을 거의 고려하지 않고 행동학적 관점에서 연구되어 왔다(Barin, 2016). 따라서 전정기능검사를 담당하는 청각전문가는 전정 보상 현상의 신경학적 기반과 전정 보상이 다양한 비디오안진검사(VNG)의 하위검사에 미치는 영향을 이해하고 있어야 한다.
말초 전정계 손상의 근본적인 원인에 관계없이 보상 과정은 동일한 것으로 보인다. 따라서 본 종설에서는 전정 병변 후 전정 보상의 신경생리학에 대한 이해를 돕기 위해 먼저 인간의 정상적인 전정기능에 대해 간략하게 검토할 것이다. 이후 병변이 발병한 직후 다양한 유형의 병변이 미치는 영향과 각 유형의 병변 발병 후 다양한 단계의 보상 과정의 임상 소견을 중점으로 설명할 것이다. 앞서 언급했듯이, 다른 측면의 보상 과정에 대한 지식이 제한적이기 때문에 본 종설에서는 VOR 경로의 보상 과정을 중점적으로 다룰 것이다.
VESTIBULAR RESPONSES TO DIFFERENT TYPES OF HEAD MOVEMENTS
말초 전정계가 손상된 경우 어떤 일이 발생하는지 이해하기 위해서는 먼저, 말초 전정계가 정상일 경우 어떤 일이 일어나는지 이해해야 한다. VOR의 역할은 머리를 움직이는 동안 망막에 이미지를 안정화시켜 선명한 시야를 제공하는 것이다. VOR에서 안구는 머리 속도와 일치하지만 반대 방향으로 움직여야 한다. 머리가 정지해 있는 경우, 큰 포유류에서 양측 수평 반고리관의 유모세포는 기준 레벨에 해당하는 약 80~100 spikes/sec의 긴장성 신경활동을 생성한다(Goldberg & Fernandez, 1971; Lysakowski et al., 1995). 각 반고리관에는 수천 개의 유모세포가 존재하기 때문에 1차 전정 뉴런은 많은 양의 신경활동을 전정핵(vestibular nuclei, VN)으로 전달한다. 머리 움직임이 없는 경우, 우측 및 좌측 미로에서 받은 신경활동은 거의 동일하다. 자연스러운 머리 움직임과 유사한 방식으로 머리를 한쪽 방향으로 움직일 경우, 양측 미로의 신경활동은 기준 레벨에서 조절된다(Barin, 2009). 선행 귀(leading ear)는 흥분성 반응을 생성하는 반면, 후행 귀(lagging ear)는 억제성 신경활동을 생성한다. 그러나 기준 레벨에서 신경활동의 변화는 머리 속도와 거의 비례한다. 전정핵 내의 2차 전정 뉴런은 우측과 좌측 신경활동의 차이를 안구운동핵으로 전달하며, 이는 반대 방향으로 움직인다는 점을 제외하고는 머리 속도와 비례하는 안구운동을 발생시킨다. VOR의 전체 과정이 상위 피질 레벨의 개입 없이 뇌간 레벨에서 발생한다는 점에 유의해야 한다. 그 결과, VOR로 생성된 안구운동은 잠복기가 매우 짧으며(각 전정안반사[angular VOR] = 14~19 msec), 이석 전정안반사(15~60 msec), 다른 유형의 안구운동보다 훨씬 빠르다. 예를 들어, 정상적인 전정기능을 할 경우에서 머리를 좌측 방향으로 회전시킬 경우 좌측(예: 머리 회전 방향)의 긴장성(tonic) 및 위상성(phasic) 신경활동성은 증가하고, 이와 상응하게 우측(예: 머리 회전 반대 방향)의 긴장성 및 위상성 신경활동성은 감소된다. 이러한 유형의 머리 회전은 말초 전정계로부터의 신경 작용에 비대칭을 생성한다. 이와 같이 말초적으로 생성된 비대칭적 신경활동은 안구운동 뉴런을 통해 외안근으로 전달된다. 안구운동 시스템에 수신된 신경 활동 패턴은 머리 회전 반대 방향으로 머리 움직임 속도에 비례하는 느린 안구운동을 생성한다. 안구가 안와의 특정 지점에 도달하게 되면, 전정 입력이 잠시 차단되므로 안구운동계는 머리 움직임 방향으로 안구를 재설정할 수 있다(예: 안진).
EFFECTS OF ACUTE UNILATERAL VESTIBULAR LESIONS
일측성 병변은 단연코 말초성 전정 이상 중 가장 흔한 유형이다. 이러한 유형의 병변은 전정경로에 머리 움직임을 모방하는 비대칭을 생성한다. 물론, 소수의 유모세포나 신경섬유가 손실된 경우에는 심각한 결과를 초래하지는 않겠지만 수평 반고리관 중 하나에서 유모세포나 구심성 신경섬유가 손상되어 기능을 상당히 상실한 경우 손상된 방향의 말초 전정계에서 전정핵으로 전달되는 긴장성 신경활동은 손상된 유모세포나 신경섬유의 수에 비례하여 감소하게 될 것이다. 이러한 비대칭적 긴장성 신경활동은 병측 반고리관 평면에서 머리가 손상된 귀 반대 방향으로 회전하고 있는 것으로 잘못 해석하게 하는 전기적 “부호화”를 생성한다. 실제로, 말초 전정기능 손실 이후 급성기 동안 환자는 자신이 머리를 건측 귀 방향으로 돌리고 있는 중이라고 지각한다(Barin, 2009). 따라서, VOR은 손상된 귀 방향으로 안구를 천천히 움직이고, 단속 안구운동계는 반대 방향으로 안구를 재설정하기 때문에 자발안진이 발생한다. 자발안진의 느린 위상 속도(slow-phase velocity, SPV)는 인지된 머리 움직임의 속도를 반영하기 때문에 중요한 매개변수이다. 병변이 발병한 당시, 자발안진의 강도는 손상된 유모세포 또는 신경섬유의 수와 직접적인 관련이 있다.
현훈은 전정핵에 등록된 비대칭으로 생성된 비정상적인 안진(예: 전정성 자발안진)의 산물이다. 정상적으로 작동하는 전정계의 경우 머리를 움직일 때, VOR는 머리 회전 반대 방향으로 머리 회전 속도와 동일하게 안구를 움직인다. VOR은 환경을 안정시키고 움직임에 대한 지각을 완화시킨다. 그러나 일측 전정기능이 상실된 경우, 머리는 정지해 있는 상태이지만, 긴장성 신경활동의 비대칭으로 인해 안진이 발생한다. 머리를 움직이고 있지 않은 상태에서도 안구가 움직이기 때문에(예: 자발안진) 환자는 회전하고 있다고 지각한다. 말초 전정계의 기능 손실로 생성된 안진은 주로 선형 수평안진으로 병변 측에서의 긴장성 신경활동 입력 손실의 직접적인 결과이다. 말초성 전정계의 기능 손실로 생성된 안진이 순수한 수평안진이 아닐 수 있는 이유는 양측 수직 반고리관(예: 후반고리관 및 전반고리관)으로부터의 입력이 완전히 상쇄되지 않아 회전성 안진 성분이 약간 남기 때문이다. 급성기일 경우 안진의 느린 위상 성분은 병측으로 향한다. 그러나 전정 보상 과정으로 인해 자발 안진의 강도는 빠르게 변화하며 안진의 방향이 항상 병측 귀를 나타내는 신뢰할 수 있는 지표는 아니라는 점에 유의해야 한다(Barin, 2016).
급성 말초성 전정기능 손실 환자는 회전성 운동의 지각 외에도 생장 증상(vegetative symptom)도 경험할 수 있다. 비대칭적 긴장성 신경활동은 전정계가 제공하는 정보(예: 환자가 머리를 회전하고 있는 중이라는 정보)와 실제로 환자는 가만히 앉아 있는 상태라는 다른 감각 기전(예: 고유수용감각 및 시각) 사이의 감각 “불일치(mismatch)”를 초래하기 때문에, 환자는 머리 움직임이 없는 상태에서도 현훈과 관련 자율신경계 증상(창백[pallor], 발한[sweating], 매스꺼움[nausea; 오심], 구토[vomiting] 등)을 경험한다. 일측성 전정 병변에 따른 다른 정적 증상에는 종종 불균형과 머리와 몸이 한쪽 방향으로 쏠리는 현상을 포함한다.
일측성 전정 병변 환자가 머리를 움직일 경우 신경 발화율의 비대칭성은 병변 발병 전의 비대칭성만큼 크지 않다. 따라서, 이로 인한 안구운동은 완전히 보상되지 않기 때문에 이미지를 망막에 고정하지 못하게 된다. 머리와 안구운동 사이의 협응이 부족한 경우 시야 흐림과 머리 움직임이 있는 동안 시력 저하와 같은 동적 증상을 유발한다(Barin, 2016).
급성 일측성 병변 이후 자연스런 머리 움직임에서 신경 발화율은 머리 속도와 일치하지 않으며, 이로 인해 발생하는 안구 운동은 머리 움직임보다 더 적다. 저주파수 정현파형 머리 움직임에서는 VOR의 이득(진폭)이 감소하고 위상 변이(timing)는 증가한다. 마찬가지로, 계단형 속도 운동(step-velocity movement)의 경우, 가속 단계 직후의 신경 반응의 진폭은 더 작고 기준선을 향한 반응의 감소(시간 상수)가 더 빠르다. 이러한 영향은 병변 방향으로 머리를 움직일 경우 더 두드러지게 나타난다. 마지막으로, VOR 경로의 비선형성은 손상된 귀 방향으로의 두부 충동 동안 정상 측의 신경 발화율을 포화시키고 안구는 머리 움직임에 훨씬 못 미친다. 이 경우 환자는 일반적으로 목표물에 재고정하기 위해 단속 안구운동(catch-up saccades)을 이용한다. 이러한 영향은 병변측 방향과 병변 반대측 방향으로의 머리 움직임에서 모두 나타나지만, 병변측 방향으로의 머리 움직임에서 훨씬 더 두드러진다(Barin, 2016).
수평 반고리관 외에도 말초 전정계 내의 다른 구조물의 손상도 다른 평면에서 머리 움직임을 모방하는 신경 발화율의 비대칭성을 유발한다(Barin, 2016). 앞서 언급한 바와 같이, 수평 반고리관 중 하나의 손상은 머리를 정상측 귀 방향으로 움직이고 있는 것으로 지각하게 하고 병변 반대측 방향으로 빠르게 박동하는 빠른 위상을 동반하는 수평 자발안진을 유발한다. 전반고리관의 국소 병변은 전반고리관-후반고리관 쌍 평면에서 머리가 후방으로 움직이는 것으로 인식되며, 이로 인해 수직 상향안진과 병변측 반대 방향으로 박동하는 회전성 안진을 유발한다. 반고리관 쌍의 시너지 효과로 인해 반대측 후반고리관의 흥분성 반응에서도 동일한 유형의 안진이 나타날 수 있다. 이러한 흥분성 반응은 후반고리관 양성돌발두위현훈(benign paroxysmal positional vertigo, BPPV)에서도 발생할 수 있지만, BPPV 유형의 안진과는 달리 전반고리관 손상 이후 안진은 지속적이다. 후반고리관의 국소 병변은 전반고리관-후반고리관 쌍 평면에서 머리가 아래쪽 방향으로 움직이는 것으로 인식되며, 이로 인해 수직 하향안진과 병변측 반대 방향으로 박동하는 회전성 안진을 유발한다. 이러한 유형의 안진은 반대측 전반고리관 BPPV에서도 나타날 수 있지만, BPPV로 인한 안진은 일시적이다. 난형낭과 구형낭의 국소 병변은 반고리관 병변에 비해 잘 알려져 있지 않다. 이석 기관 중 하나가 손상되면 중력에 대한 방향감각이 상실되고, 머리가 병변 반대측 방향으로 기울어져 있는 것으로 인식될 수 있다. 이 가설과 일치하게 인간에서 이석 기관의 국소 병변은 안구를 병변측 방향으로 긴장성 회전시킨다는 것이 입증되었다. 이러한 유형의 회전성 안구운동은 주관적 시수직감검사(subjective visual vertical test)로 검사할 수 있다. 이석 기관의 국소 병변이 어느 정도 흔한지는 명확하지 않다. 그러나 BPPV 환자에서 이석정복술을 성공한 후에도 남아 있는 가벼운 증상은 이석 기관의 이상 중 한 가지 형태일 수 있다. 결국, 이러한 환자에서 난형낭에 존재하는 이석의 상당한 손실은 정상적인 이석 기능을 방해할 수 있다(Barin, 2016).
다양한 전정신경 가지에서의 병변 발현은 해당 전정신경 가지를 통해 매개되는 다양한 반고리관 또는 이석 기관의 영향을 조합하여 판단할 수 있다. 예를 들어, 상전정신경은 수평 반고리관과 전반고리관뿐만 아니라 난형낭의 정보를 전달한다. 구형낭으로부터의 소수의 신경섬유도 상전정신경을 통과하지만, 그 효과는 일반적으로 미미하다(Hain, 2007). 그 결과 상전정신경의 손상에서는 병변 반대측 방향으로 박동하는 수평안진과 수직 상향 안진, 병변 반대측 방향의 회전성 안진, 병변측 방향의 긴장성 안구 회전이 발생한다. 이와 유사하게 하전정신경은 후반고리관과 구형낭의 정보를 전달한다(Hain, 2007). 하전정신경의 손상에서는 병변 수직 하향안진, 병변 반대측 방향의 회전성 안진, 병변측 방향의 긴장성 안구 회전이 발생한다. 마지막으로 상·하전정 신경 모두의 손상 또는 전체 미로 병변은 미로 내의 개별 구조에 대한 모든 병변의 조합을 유발한다(Barin, 2016). 그러나 안진의 수직 성분은 그 방향이 반대로 향하므로 결국 상쇄된다. 이로 인해, 상·하전정신경 모두의 손상 또는 전체 미로 병변에서는 병변 반대측 방향으로 박동하는 수평 안진과 병변 반대측 방향의 회전성 안진, 병변측 방향의 긴장성 안구 회전이 발생한다(Barin, 2016).
EFFECTS OF ACUTE BILATERAL VESTIBULAR LESIONS
양측성 전정 병변은 일측성 병변에 비해 드문 편이다. 양측성 전정 병변은 두 가지 원인 중 하나로 발병할 수 있다. 양측 말초 전정계의 기능 손실 정도가 거의 동일할 경우, 환자는 앞서 설명한 정적 증상을 거의 나타내지 않는다. 즉, 이 경우 신경활동의 비대칭성이 발생하지 않기 때문에 일측성 전정 병변의 전형적인 중상인 현훈과 자발안진은 나타나지 않는다. 그러나, 이러한 환자는 일반적으로 머리를 움직이는 동안 불안정감(unsteadiness), 동요시(진동시; oscillopsia) (머리를 움직이는 동안 정지되어 있는 물체가 움직이고 있다고 느껴지는 감각), 시야 흐림과 같은 동적 증상을 경험한다(Jen, 2009). 급성 증상은 일측성 전정 병변으로 인한 증상만큼 문제가 큰 것처럼 보이지 않을 수 있지만, 양측성 전정 병변의 장기적인 기능적 결과는 훨씬 더 심각하고 극복하기가 더 어렵다(Kim et al., 2011).
양측 전정기능 손실이지만 어느 한쪽 전정기능의 손실이 더 심한 환자는 앞서 설명한 일측성 전정 병변과 관련된 두 가지 증상뿐 아니라 앞서 설명한 양측 전정기능 손실과 관련된 증상도 나타낸다(Fujimoto et al., 2013). 이러한 유형의 병변의 결과는 급성기와 만성기 모두에서 매우 심각하다(Guinand et al., 2012).
EFFECTS OF ACUTE CENTRAL VESTIBULAR LESIONS
전정핵에 영향을 미치는 국소 병변에 대해서는 알려진 바가 거의 없다. 전정핵의 손상이 어느 한쪽 이차 전정신경 세포의 긴장성 신경활동에 영향을 미친다면, 증상과 증세(presentation)는 일측성 말초 전정 병변과 유사할 것으로 예상된다. 그러나 임상 양상은 더 복잡하다. 인간에서 전정핵을 손상시키는 대부분의 질환은 혈관 질환, 종양 또는 외상 때문이다(Furman & Whitney, 2000). 이로 인해, 영향은 반드시 전정핵에만 국한되어 나타나지 않으며, 종종 뇌간, 소뇌 또는 소뇌피질(cerebellar cortex) 내 구조물을 포함한다. 동물 연구에 따르면 전정핵의 국소 병변 이후 자발안진이 나타났다. 그러나 말초성 전정 병변과 달리, 전정핵의 국소 병변은 caloric weakness를 유발하지는 않았다. 대신, 온도검사 결과에서는 이상 안진(perverted nystagmus)과 그 외 중추성 소견이 포함된다(Barin, 2016).
중추성 전정 병변에 대해서도 조금씩 이해되고 있음은 분명하다. 중추성 전정 병변 이후의 보상 과정에 대해서도 간단히 언급하겠지만, 효과적인 재활 방법이 고안되기 전에 이러한 장애의 근본적인 병태생리학에 대한 더 많은 이해가 필요하다.
NEURAL BASIS OF VESTIBULAR COMPENSATION
전정경로는 환경 변화와 노화와 같은 발달적 변화의 영향을 극복하는 데 필수적인 높은 수준의 가소성을 가지고 있다(Zee, 2007). 시야를 반전시키는 특수 안경을 착용한 후에도 VOR 이 제대로 작동한다는 사실은 이러한 가소성의 놀라운 증거이다(Melvill Jones et al., 1988). 전정 보상 과정에도 동일한 적응 기전이 관여하므로 환자는 전정 병변 후 기능적으로 회복할 수 있다. 즉, 전정계는 한쪽의 전정 입력이 급격히 손실된 동안 활성화되는 훌륭한 적응 기전을 가지고 있다. 말초 전정계의 손상으로 인해 신경 발화율의 비대칭성 증가된 경우, 이러한 신경 발화율의 비대칭성을 제거하기 위해 먼저 중추 전정계의 구조물이 동원된다. 이후 VOR의 동적 기능(dynamic function)을 복원하는 과정을 시작한다. 이 과정을 “전정 보상”이라고 하며, 두 가지 주요 단계에 걸쳐 발생한다(Lacour, 2006). 첫 번째 단계는 전정핵에서 긴장성 신경활동의 균형을 재조정하여 안구운동 증상(전정성 자발안진, 사편시[skew deviation], 안구 회전[cyclotorsion])의 조합인 안구-기울기 반응(oculartilt reaction), 자세 증상(머리와 신체가 병변 방향으로 기울어짐) 및 지각 증상(현훈, 주관적인 시수직감의 기울어짐) 등을 제거하는 “정적 보상(static compensation)”이다. 정적 보상은 머리를 움직이지 않은 상태에서 나타나는 보다 고통스러운 증상을 완화시키기 위해 병변 발병 거의 직후 시작한다. 이러한 정적 증상은 완전히 보상되지만 동물(쥐, 기니피그의 경우 1주, 고양이의 경우 6주)보다 일측성 전정기능 손실 환자(자세 및 안구운동 결함의 경우 3개월, 수직감 지각의 경우 최대 1년)에서 더 긴 시간 상수가 필요하다(Lacour et al., 2016). 두 번째 단계는 VOR의 보상 작용을 동적결함(VOR 이득 감소 및 위상 편이[phase shift], VOR 시상수 감소, 까다로운 조건에서 균형 조절의 손상) 전 수준으로 복원하기 위해 VOR의 반응 특성(예: 타이밍 및 이득)의 중추성 재교정을 포함하는 동적 보상(dynamic compensation) 단계로 정적 보상과 거의 동시에 시작되지만 훨씬 더 미묘하고 더 오래 걸린다(Lacour et al., 2016). 동적 보상은 전정계 손상으로 인한 장기적인 부정적 영향을 완화하기 위해 발생한다. 동적 보상은 복잡한 과정으로 일부 환자의 증상을 완전히 해결하지 못할 수 있는 것으로 보인다. 환자의 보상 단계는 다양한 VNG 하위검사 결과에 매우 큰 영향을 미칠 수 있으므로, 전정 보상의 기본 기전에 대한 이해는 모든 청각전문가에게 중요하다. 그러나 전정 보상은 전정경로의 적응에 국한되지 않으며, 단속 안구운동계와 같은 다른 안구운동 기전과 자세 조절 기전으로 대체될 수 있다(Curthoys, 2000).
전정 보상 기전을 매우 단순화하여 Figure 1에 나타내었다. 머리의 움직임은 미로 내의 유모세포에 의해 신경활동으로 변환된다. 신경활동의 변화는 전정신경 내의 일차 전정 뉴런을 통해 전정핵으로 전달된다. 이차 전정 뉴런은 일반적으로 신경활동을 안구운동핵이나 척수와 같은 운동 중추로 전달한다. 소뇌는 전정핵 내 신경활동의 변화를 지속적으로 감시하지만 전정계의 예상 반응 범위에 있는 한 개입하지는 않는다. 그러나 신경활동의 변화가 전정계의 예상 반응과 일치하지 않을 경우 전정 보상 기전은 2차 전정 뉴런을 변화시켜 운동 중추가 1차 전정 뉴런 활동의 수정된 표현을 받도록 한다. 전정핵 레벨에서의 변화에는 이득의 감소, 이득의 증가, 시간의 변화 또는 그 외 신경활동 변경을 포함할 수 있다. 이러한 관점의 전정 보상 과정에서 소뇌(소뇌 편엽[cerebellar flocculus])는 보상 과정을 시작하는 데 중요한 역할을 한다(Courjon et al., 1982; Johnston et al., 2002).
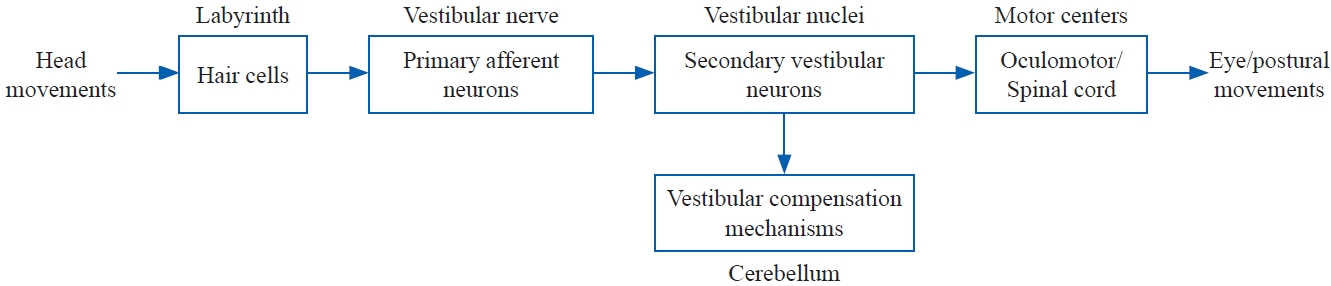
A simplified representation of the vestibular compensation process (Barin, 2016).
COMPENSATION AFTER UNILATERAL VESTIBULAR LESION
갑작스러운 일측 말초성 전정 병변 이후 대부분 환자의 불만 사항은 전형적인 양상을 따른다. 이 환자는 일반적으로 며칠 동안 심각한 증상과 종종 무력감(disabling symptom)을 나타내며, 수주 동안 중등도 증상과 증상의 호전이 이루어진 후 수개월 동안 경미하고 관리 가능한 증상을 나타낸다(Halmagyi et al., 2010). 물론, 연령, 활동 수준 및 기타 교란 질환(confounding condition)의 존재 여부에 따라 개인차가 발생한다. 그럼에도 불구하고 이러한 비교적 보편적인 회복 양상은 이후 설명할 다양한 보상 단계에 해당한다.
말초성 전정 병변 발병 후 다양한 정적 보상 과정 단계를 설명하기 위해 단순화시키고 몇 가지 가정을 할 것이다. 첫째, 여기서는 수평 평면에서 VOR의 회복만 고려하였지만 보상 과정은 다른 평면의 VOR에서도 유사하다. 또한 말초 전정계 손상이 완료된 것으로 가정한다. 마지막으로, 단일 신경섬유의 신경활동을 나타내며 긴장성 신경 발화율은 100 spike/sec라고 임의로 가정한다.
PRIOR TO THE ONSET OF LESION
정상인에서 좌측 귀 방향으로의 갑작스러운 수평 머리 회전 직후 전정핵에서의 신경활동을 생각해보자. 머리 속도의 특정 변화에서 신경 발화율의 순간적 변화는 50 spikes/sec라고 다시 임의로 가정한다. 머리 회전 개시 직후 좌측으로부터의 흥분성 반응과 우측으로부터의 억제성 반응의 차이는 100 spikes/sec (2 × 50 spikes/sec)이다. 정상인에서는 VOR이 정상적으로 작동하기 때문에, 머리 움직임은 신경활동 양상으로 정확하게 외삽(extrapolate)되고, 머리 속도와 일치하는 SPV을 동반하는 동시에 머리 움직임과 반대 방향으로 향하는 보상적 안구운동을 생성한다. 머리를 계속해서 회전시킴에 따라 안구가 안와의 한계점에 도달한 경우 단속 안구운동계는 안구를 재설정하며 빠른 위상이 머리 가속 방향으로 향하는 안진을 생성한다(이 예시에서는 left-beating) (Figure 2).
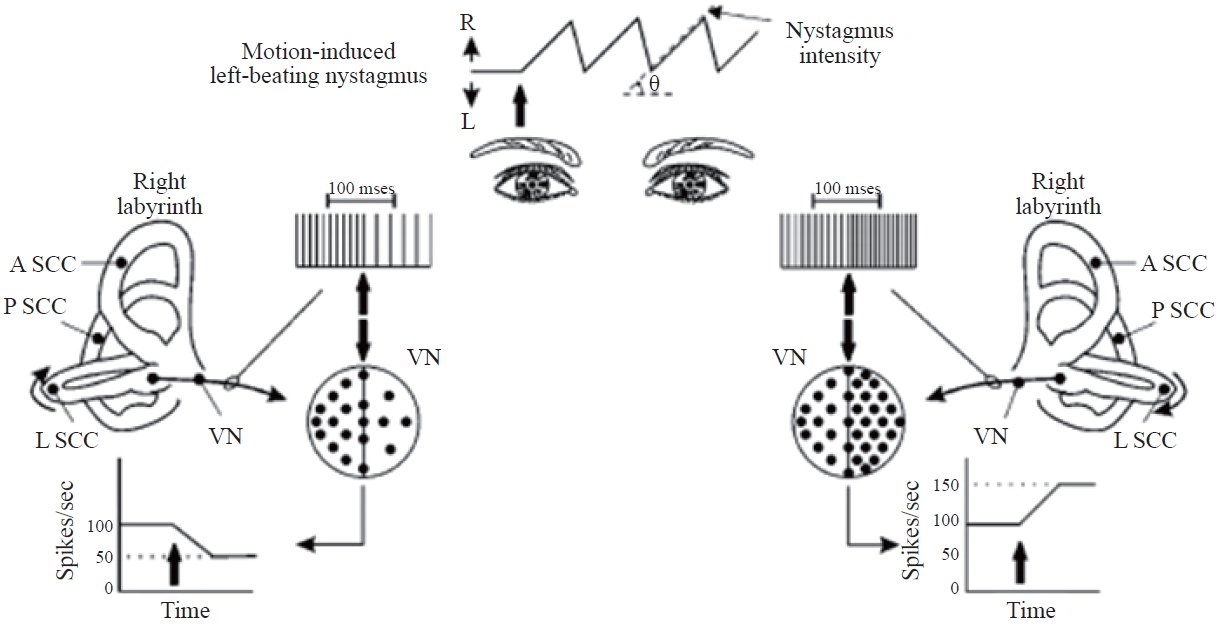
The neural activity at the vestibular nuclei (VN) of a normal individual immediately following a sudden horizontal head rotation toward the left ear. R: right, L: left, A SCC: anterior semicircular canal, P SCC: posterior semicircular canal, L SCC: lateral semicircular canal. Based on Barin (2016).
IMMEDIATELY AFTERTHEONSETOF LESION
우측 수평 반고리관 또는 그 구심성 신경경로 병변 직후 전정핵에서의 신경활동을 생각해보자. 신경 비대칭성은 머리를 좌측으로 회전하고 있는 것으로 지각하게 하며, 빠른 위상이 지각된 머리 움직임 방향 및 병변 반대측 방향으로 향하는 자발안진을 생성한다(Fetter & Zee, 1988) (Figure 3). 또한 두 질환 모두에서 신경 비대칭성은 100 spikes/sec로 동일하기 때문에 이 예에서 안진의 SPV는 정상인에서 좌측 귀 방향으로의 갑작스러운 수평 머리 회전 직후(Figure 2)와 동일하다. 자발안진의 SPV는 자신의 머리가 얼마나 빨리 회전하고 있는지에 대한 환자의 지각을 반영하며, 결과적으로 증상의 중증도와 직접적인 관련이 있다는 점에 유의해야 한다.

The neural activity at the vestibular nuclei (VN) immediately following a lesion in the right lateral semicircular canal or its afferent neural pathway. R: right, L: left, A SCC: anterior semicircular canal, P SCC: posterior semicircular canal, L SCC: lateral semicircular canal. Based on Barin (2016).
우측 수평 반고리관 또는 그 구심성 신경경로 병변 직후 단계에서 전정기능 검사 소견은 상당한 우측 일측성 caloric weakness와 시고정을 하지 않은 상태에서 강한 left-beating 자발안진을 포함해야 한다. 안진은 일반적으로 매우 강하기 때문에 시고정 상태에서도 완전히 억제되지 않고 관찰될 수 있다. 이러한 안진은 Alexander’s law(안진의 빠른 위상 방향으로 주시할 경우[이 예에서는 좌측 주시 시 안진이 더 강해짐을 의미함])을 따를 가능성이 높다(Hegemann et al., 2007). 두부 충동 검사(head impulse test)에서는 VOR 이득 감소와 우측 방향의 두부 충동 시 catch-up saccade가 일관되게 나타나야 한다(Weber et al., 2008). 좌측 방향의 두부 충동에서도 동일한 결과가 나타날 수 있지만 우측 방향의 머리 충동만큼 두드러지 지는 않다. 회전의자 검사에서는 매우 낮은 주파수에서 이득 감소와 위상 증가가 나타나야 한다(Baloh et al., 1989). 또한, 비대칭성은 자발안진의 존재를 반영하는 모든 주파수에서 유의해야 한다(Magnusson et al., 1989). 그러나 병변 발병 시 회전의자 검사에서는 매우 빠른 머리 움직임으로 발생하는 것과 동일한 유형의 비선형성도 발생할 수 있으므로 병변 초기 단계의 회전의자검사 소견은 신중하게 해석해야 한다.
마지막으로, 전정유발근전위(vestibular evoked myogenic potential, VEMP)검사의 반응은 이석 기관에서 기인하는 것으로 가정하고 있다. 따라서, VEMP 검사 결과는 손상이 전정신경을 포함하는지 여부에 달려 있다. 그럼에도 불구하고 VEMP 검사는 온도검사와 유사하게 병변에 따라 달라지고, 전정 보상으로 변화될 가능성이 낮기 때문에 여기서 더 이상 논의하지는 않을 것이다.
CEREBELLAR CLAMPING STAGE
말초성 전정 병변으로 야기되는 신경 비대칭(Figure 3)은 한 가지 주목할 만한 예외를 제외하고 머리 움직임으로 야기되는 신경 비대칭(Figure 2)과 유사하다. 머리 움직임으로 유발되는 좌·우측 신경 발화율 사이의 신경 비대칭은 일시적이며 장기간 지속되지 않는다. 그에 비해 병변으로 유발되는 신경 비대칭성은 지속적이다. 따라서, 장기적이고 지속적인 비대칭성은 VOR 경로 내에서 오작동의 징후로 해석되어 결과적으로 전정 보상 과정을 활성화시킨다(Barin, 2016).
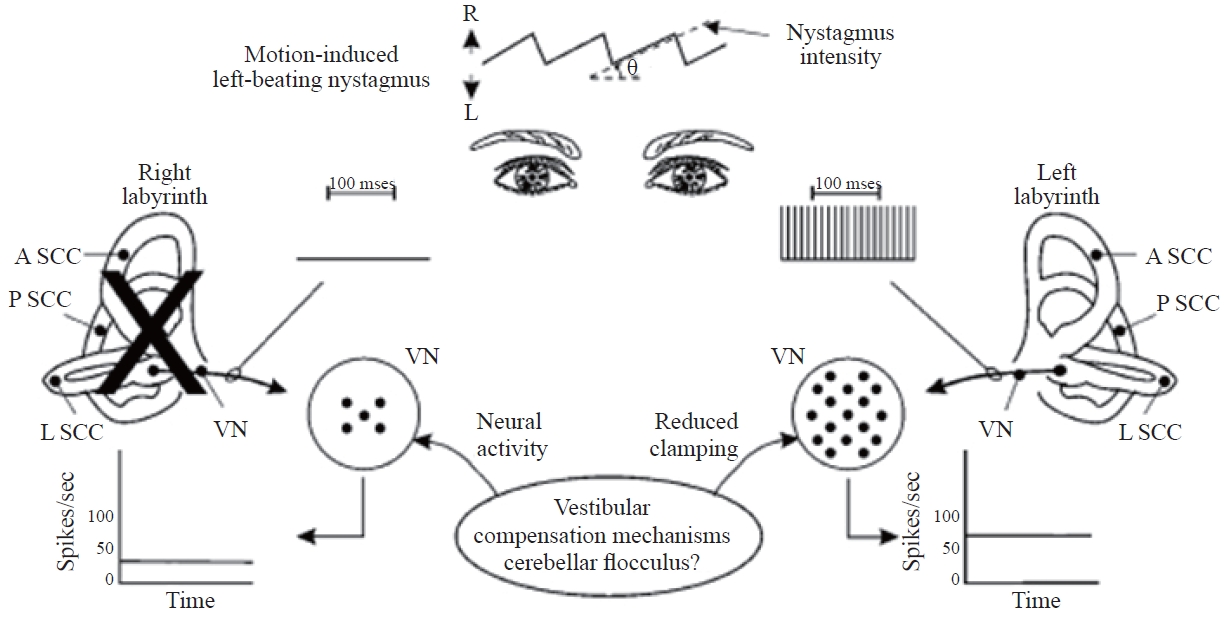
전정 보상 과정의 첫 번째 단계는 소뇌 클램핑(cerebellar clamping)으로, 이는 정상측에서 기인한 신경활동을 운동 중추로 전달하기 전에 전정핵 레벨에서 감소시킨다(Figure 4). 이러한 전정 보상 단계는 병변이 발병된 후 몇 분이 아니라 몇 시간 내에 시작되며 그 효과는 비대칭성을 줄이고 환자의 증상을 완화시키는 것이다. 이는 증상이 심할 가능성이 높은 병변의 초기 단계에서 전정 억제제 복용과 본질적으로 동일한 역할을 한다. 소뇌 클램핑은 정적 증상을 완화시켜주지만 동적 증상에는 단기적인 역효과(악영향)를 미칠 수 있다는 점에 유의해야 한다. 그 이유는 소뇌 클램핑이 머리를 움직이는 동안 정상측 신경 활동을 감소시켜 VOR 기능을 더욱 손상시키기 때문이다(Barin, 2016).

Static vestibular compensation following a right peripheral vestibular lesion. The first step in the vestibular compensation process is cerebellar clamping in which the neural activity from the intact side is reduced at the vestibular nuclei (VN) level before it is relayed to the motor centers. R: right, L: left, A SCC: anterior semicircular canal, P SCC: posterior semicircular canal, L SCC: lateral semicircular canal. Based on Barin (2016).
소뇌 클램프 단계에 대한 증거는 Vibert et al.(1999)에서 도출되었다. 이 연구진들은 일측 미로절제술(labyrinthectomy)을 받은 기니피그를 대상으로 연구하였다. 1차로 미로절제술을 시행한 후 3일 이내에 2차로 반대쪽 전정신경절제술을 시행한 경우 그 영향은 미미하였다. 이는 소뇌 클램핑으로 인해 초기에 정상측의 신경활동이 이미 감소하였으며 이것이 후속 구심로 차단(deafferentation)의 효과가 미미했던 이유임을 시사한다.
소뇌 클램프 단계에서 전정기능검사 결과에는 시고정을 하지 않은 상황에서 유의한 자발안진이 나타나야 한다. 단, 병변 발병 당시보다 강도는 감소되어야 한다. 이는 신경 비대칭성의 감소를 반영하고 환자의 증상 개선을 동반한다. 우측 미로 손상의 경우 온도검사에서는 계속해서 상당한 right weakness를 나타내어야 하지만, 강력한 소뇌 클램핑 효과로 인해 때때로 양측 반응이 모두 약해질 수 있다. 회전의자검사에서는 소뇌 클램핑 효과로 인해 이득이 다시 감소할 수 있지만, 병변 발병 당시의 이득과 유사해야 한다. 자발안진 강도의 감소로 인해 회전의자검사의 비대칭성도 감소해야 한다. 마찬가지로, 두부충동검사 결과는 병변 발병 당시의 결과와 유사해야 한다(Barin, 2016).
NEURAL ACTIVITY AT THE VESTIBULAR NUCLEI OF THE AFFECTED SIDE
소뇌 클램프 단계 직후, 병변측 전정핵에서 2차 전정 뉴런의 긴장성 신경활동이 증가하기 시작한다. 말초성 전정 병변이 영구적이라고 가정할 경우, 이러한 신경활동은 일차 전정 뉴런에서 기인할 수 없다. 대신, 신경활동을 증가시키는 가장 가능성 있는 근원은 교련섬유(commissural fiber)를 통해 다른 쪽과 소통하는 정상측의 전정핵이다(Olabi et al., 2009). 병변측의 신경활동이 증가함과 동시에 정상측의 소뇌 클램핑 효과는 감소한다(Beraneck et al., 2004) (Figure 5). 신경 비대칭은 여전히 존 재하지만, 병변 발병 당시에 비해 심하지는 않다. 또한, 소뇌 클램핑의 감소는 정상측 신경활동이 머리 움직임을 더 잘 대변할 수 있게 한다. 요컨대, 환자는 여전히 정적 및 동적 증상을 모두 겪을 것이지만, 두 증상의 중증도는 모두 완화된다.
Static vestibular compensation following a right peripheral vestibular lesion. Simultaneous with the increase of neural activity on the affected side, the clamping effect on the intact side is reduced. R: right, L: left, A SCC: anterior semicircular canal, P SCC: posterior semicircular canal, L SCC: lateral semicircular canal, VN: vestibular nuclei. Based on Barin (2016).
이 전정 보상 단계에 대한 증거도 Vibert et al.(1999)에서 도출되었다. 이 연구에 따르면 기니피그를 대상으로 1차 미로 절제술을 시행한 후 3일 이후 2차로 전정신경절제술을 시행한 경우 증상의 악화를 다시 경험하고 자발안진이 나타났으나 이번에는 미로절제술 직후 초기 자발안진과 그 방향은 반대였다. 이는 병변측 전정핵의 신경 활동이 증가하여 이후 전정신경절제술이 반대 방향으로 2차적인 비대칭성을 생성하였음을 시사한다. 이 실험 동물은 미로절제술을 시행받았기 때문에 신경활동의 증가는 중추에서 발생하였음에 틀림없다.
다시 언급하지만, caloric weakness가 지속되더라도 전정기능검사에서 자발안진의 강도는 계속 감소한다. 회전의자검사에서 특히 저주파수의 경우에는 위상 및 이득 매개변수가 개선되어야 하며, 자발안진의 강도가 감소함에 따라 비대칭성 매개변수도 감소해야 한다(Allum & Honegger, 2013). 앞서 언급한 바와 같이, 회전의자검사 결과의 변화가 전정 보상과 어느 정도 직접적으로 관련되어 있는지, 그리고 이러한 매개변수의 계산 방식에 어느 정도로 많은 영향을 미치는지 명확하지 않다. 마지막으로, 두부충동검사 결과는 한 가지 가능한 예외를 제외하고 본질적으로 변화되지 않고 그대로 유지된다. Catch-up saccade의 잠복기는 전정 보상과 함께 감소하여 두부 충동 동안 발생한다(MacDougall et al., 2009). 이러한 catch-up saccade는 두부 충동 이후 발생하는 현성 단속 안구운동(overt saccade)과는 반대인 숨은 단속 안구운동(covert saccade)라고 불린다. Coverts saccade는 보다 빠르게 목표물을 안구에 배치하고 시야를 안정화시키기 때문에 보다 효율적인 것으로 추정된다(Macdougall & Curthoys, 2012).
STATIC COMPENSATION
병변측 신경활동의 증가 과정은 손상 전 신경활동 수준으로 돌아갈 때까지 계속되며 동시에 정상측의 소뇌 클램핑은 완전 정상 수준으로 돌아올 때까지 계속 감소한다. 이 시점에서 환자는 신경 비대칭성이 사라지고, 머리가 정지되어 있는 한 증상은 더 이상 발현되지 않기 때문에 정적 보상을 달성한 것이다(Halmagyi et al., 2010).
전정기능검사 결과는 이전 단계의 추세를 계속 따른다. 자발안진은 완전히 사라지거나 강도가 미미한 수준으로 감소해야 한다. 그러나 caloric weakness는 이전과 같이 지속되어야 한다. 회전의자검사의 경우, 위상 매개변수는 병변 발병 전 수준보다 높은 수준으로 안정되어야 하며 이득 매개변수는 병변 발병 전 수준보다 낮은 수준으로 안정되어야 한다(Baloh et al., 1989). 마찬가지로, 비대칭성 매개변수는 자발안진 강도와 따라 유의하지 않은 수준으로 떨어져야 한다. 두부충동검사 결과는 이전 전정 보상 단계의 결과와 비슷해야 하지만 아마도 이전 전정 보상 단계보다 covert saccade가 더 많이 출현할 것이다.
정적 보상은 말초성 전정 병변으로부터의 회복에 중요한 이정표를 나타낸다. 따라서, 정적 전정 보상을 잘 이해해야 한다: 첫째, 동물에서 움직임과 시각 자극을 제한시킨 경우 정적 보상 과정은 지연되고 회복이 결코 완료되지 않을 수 있다(Zee, 2007). 인간의 경우, 머리-안구의 협응운동이 회복을 촉진할 수 있지만, 정적 보상은 자발적으로 발생하는 것으로 보인다. 둘째, 이론적으로, 정적 보상은 신경 비대칭성의 완전한 해결과 자발안진의 소멸을 요구한다. 실제로, 환자가 이러한 비대칭성을 머리 움직임으로 더 이상 지각하지 않도록 하는 역치에 도달할 때까지 보상 과정은 계속 진행되기 때문에 약간의 비대칭성은 무한정 지속될 수 있다. 이러한 비대칭성은 징후는 SPV가 특정 역치 미만(일반적으로 4°/s)인 자발안진의 지속적인 출현이다. 셋째, 정적 보상은 병변이 갑자기 발생하든 점진적으로 발생하든 상관 없이 발생한다. 예를 들어, 전정신경초종 환자는 일반적으로 급성 말초 전정기능 손실과 관련된 대부분의 증상을 경험하지 않는다(Parietti-Winkler et al., 2011). 그 이유는 종양이 점진적으로 성장하면서 전정신경에 영향을 미치기 때문에 명백한 징후를 발현시키지 않으면서 점진적으로 정적 보상이 이루어지기 때문이다(Uehara et al., 2011). 마지막으로 정적 보상은 병변이 안정적일 때 가장 효과적이다. 메니에르병과 같이 변동성 병변을 앓고 있는 환자는 특히 발작이 빈번한 경우 변동성이 없는 안정적인 병변을 가진 환자만큼 보상이 잘 이루어지지 않을 수 있다(Lacour et al., 2009). 실제로, 변동성 병변을 앓고 있는 환자는 보상 과정에서 흥미로운 반응 양상을 나타낼 수 있다. 유모세포나 신경섬유가 손상된 후 보상 과정은 병변의 안정성 또는 변동성 여부와 상관없이 소뇌 clamping 단계로 진행될 것으로 예상된다(Figure 4). 그러나 clamping 단계에서 손상된 미로의 기능이 회복된 경우 비대칭성은 갑자기 역전될 것이다(Figure 6). 이 경우 환자는 이제 소뇌 clamping의 효과를 역전시키고 신경 대칭성을 회복하기 위해 또 다른 보상 단계를 거쳐야 한다. 사실상 이러한 추가적인 보상 과정은 환자가 증상으로 고통받는 시간을 연장한다. 바로 이러한 점이 메니에르병의 관리 방법 중 하나로 병측 미로를 파괴시켜 손상을 영구적으로 만드는 시술을 이용하는 이유이다. 변동성 병변의 발작이 빈번하지 않는 경우 보상 과정의 비효율성은 장기적인 영향을 미치지 않을 수 있다. 그러나 발작이 빈번한 환자에서 보상 기전은 효용성이 없고 증상을 연장시키기 때문에 보상 기전이 작동하지 않을 수 있다.
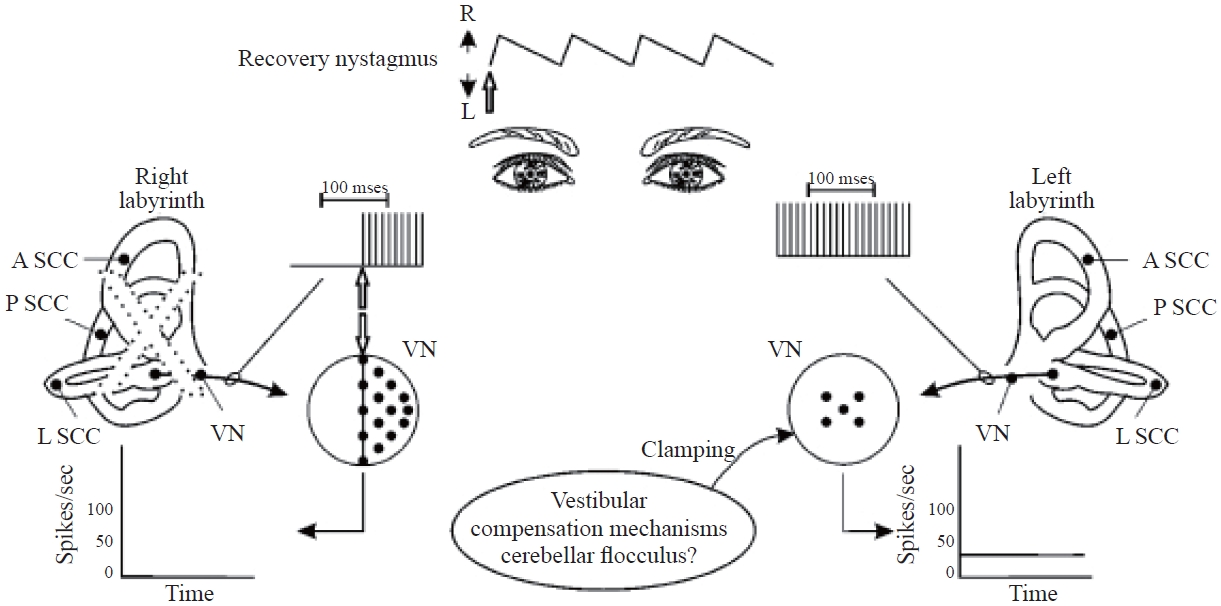
Mechanism of recovery nystagmus in fluctuating lesions. Hollow arrows identify the onset of restoration of neural activity after the lesion. R: right, L: left, A SCC: anterior semicircular canal, P SCC: posterior semicircular canal, L SCC: lateral semicircular canal, VN: vestibular nuclei. Based on Barin (2016).
신경 비대칭성의 반전은 자발안진 방향의 반전을 초래한다(McClure et al., 1981) (Figure 6). 병변측 방향으로 박동하는 이러한 유형의 자발안진은 때때로 변동성 병변에서 관찰될 수 있다. 병변측 방향으로 박동하는 자발안진은 병변측의 전정기능이 회복되어 발생하기 때문에 회복 안진(recovery nystagmus) 이라고 한다. 소뇌 클램핑이 발생한 측의 신경활동은 비대칭성이 해결되기 전까지 급격히 증가하기 때문에 유의미한 회복 안진의 출현 기간은 짧다. 그러나 위의 2번 항목에서 설명한 것과 같은 이유로 병변측 방향으로 박동하는 경미한 잔존 자발안진은 지속될 수 있다. 즉, 양측 신경활동의 비대칭성이 더 이상 머리 움직임으로 인식되지 않는 수준 이하로 감소되면 신경활동의 변화는 중단된다. 이 설명은 또한 자발안진의 방향이 병변측을 항상 확인해주는 것은 아니라는 분명한 예를 제공한다.
DYNAMIC COMPENSATION
정적 보상 이후 머리를 정지하고 있을 경우 환자는 더 이상 증상을 겪지 않지만 머리를 움직이는 즉시 환자는 시야 흐림과 시력 손실을 경험할 수 있다. 이러한 근본적인 이유는 다음과 같다. 병변이 발병되기 전과 정확히 같은 방식으로 머리를 움직일 경우 정적 보상 이후 이로 인한 신경 비대칭성은 병변이 발병하기 전에 비해 거의 절반에 불과하다. 따라서, 머리 속도는 실제로 움직인 속도의 절반에 불과한 것으로 해석되어 안구는 필요한 속도의 1/2 속도로만 움직이게 된다(Figure 7). 머리 속도와 안구운동 속도의 차이를 망막상 이탈(retinal slip)이라고 한다. 망막상 이탈이 0에 가깝지 않는 경우 망막에 상(image)을 고정하지 못해 환자는 시야 흐림을 경험한다.
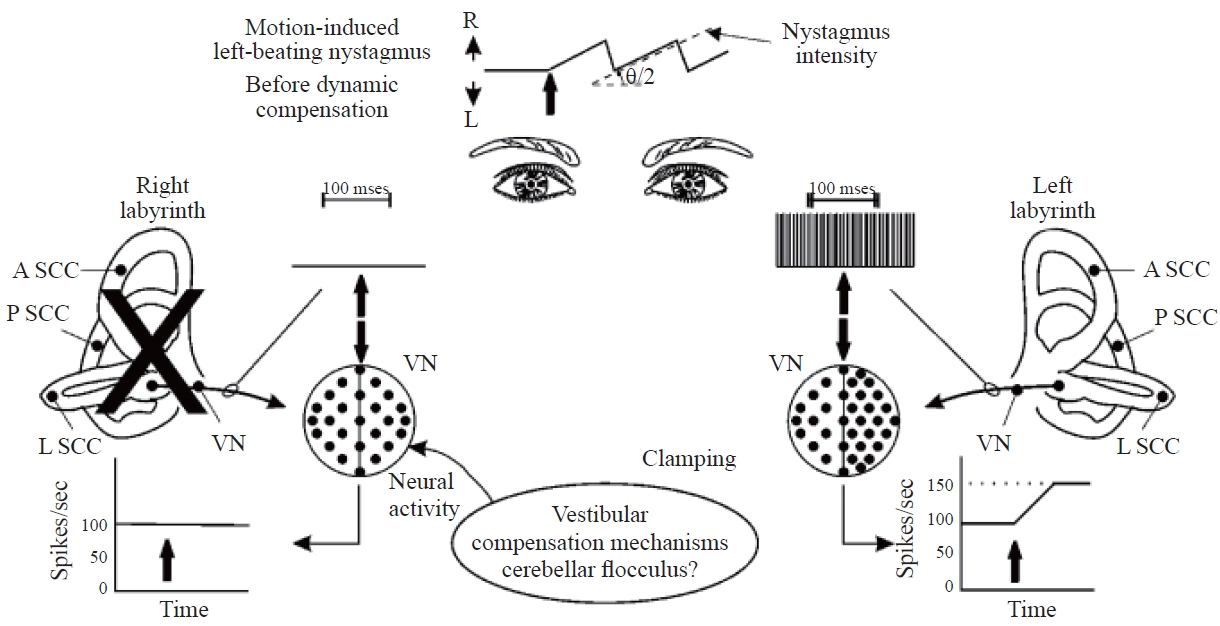
Before dynamic vestibular compensation. R: right, L: left, A SCC: anterior semicircular canal, P SCC: posterior semicircular canal, L SCC: lateral semicircular canal, VN: vestibular nuclei. Based on Barin (2016).
VOR 성능을 개선하고 망막상 이탈을 최소화할 수 있는 한 가지 방법은 동일한 머리 속도에 대한 이차 전정 뉴런의 신경활동을 병변 전 수준으로 증가시키는 것이다. 이러한 VOR 이득의 증가가 발생한다는 직접적인 증거는 없지만 몇 가지 강력한 상관관계가 있다. 출구가 작은 저장 탱크처럼 작동하는 속도저장 기전의 기능을 상기해보자. VOR 이득은 속도저장 기전에서 신경 활동의 유출을 증가시킴으로써 증가시킬 수 있다(Figure 8). 이는 VOR 이득을 증가시키지만, 속도저장 기전의 주요 기능인 저주파수에 대한 VOR 성능을 저하시키기도 한다(Laurens et al., 2011). 저주파수에서 VOR 기능의 감소는 실제로 저주파에서 위상 매개변수가 증가하고 이득 매개변수는 감소하는 회전의자 검사 결과로 분명하게 나타난다(Baloh et al., 1989).

After dynamic vestibular compensation. R: right, L: left, A SCC: anterior semicircular canal, P SCC: posterior semicircular canal, L SCC: lateral semicircular canal, VN: vestibular nuclei. Based on Barin (2016).
동적 증상의 원인을 이해하면 동적 증상의 보상 과정이 정적 보상보다 훨씬 더 어려운 이유에 대한 단서를 제공한다. 앞서 설명한 것처럼, 다양한 유형의 머리 움직임과 다양한 신경활동 양상을 연관시키는 내부 데이터베이스는 수년에 걸쳐 개발된다. 일측성 전정 병변 후 이 데이터베이스는 더 이상 머리 움직임을 정확하게 측정할 수 없으므로 교체해야 한다. 신경 발화 패턴과 머리 움직임 사이의 관계를 재정립하는 데 필요한 것으로 보이는 기간 외에도, 원래의 데이터베이스는 감각 및 운동 기전이 최고의 성능을 발휘하는 연령대에 개발된다는 것을 명심해야 한다. 전정 이상의 발병률은 노년기에 더 높으며, 노인 환자는 감각 및 운동 경로의 예민함 감소와 같은 노화의 공통적인 다른 혼란스러운 문제들 때문에 동적 보상에 더 어려움을 겪는다. 이는 또한 동적 보상에 성공한 일부 환자가 간헐적 보상기능 상실(episodes of decompensation)에 취약한 이유를 설명할 수 있다(Katsarkas & Segal, 1988). 즉, 보상 기전이 새로운 신경행동 양상을 “잊어버리고” 원래의 데이터베이스로 되돌아가는 것처럼 보이기 때문에 겉보기에는 무관해 보이는 사건이 일련의 증상을 촉발할 수 있다(Barin, 2016).
동적 보상 달성의 개념적 어려움 외에도 동적 보상 평가에도 임상적 문제가 있다. 즉, 온도검사와 같은 대부분의 전정기능검사의 결과는 동적 보상 전·후가 동일하며 보상 상태 및 수준에 대한 정보는 거의 제공해주지 않는다(Slattery et al., 2011). 정적 보상의 척도인 자발안진의 강도와 유사하게 동적 보상의 가장 좋은 척도는 망막상 이탈이다. 그러나 대부분의 기존 전정기능검사는 망막상 이탈을 직접적으로 측정할 수 없다. 망막상 이탈을 간접적으로 측정할 수 있는 한 가지 검사는 동적시력검사(dynamic visual acuity test)이다(Mohammad et al., 2011). 그러나 동적시력검사는 다수의 잡파가 발생하기 쉬우므로 동적 보상을 평가하는 데 있어 효율성이 떨어진다. 동적자세검사(dynamic posturography)는 동적 보상을 평가하는 또 다른 방법이지만, 일측성 전정 병변 이후의 자세조절 이상은 대개 매우 빠르게 해결되므로 환자의 동적 증상과 일치하지 않는 경우 가 많다(Furman, 1994).
동적 보상 과정에 대해 밝혀진 지식이 정확하다면 동적 보상을 용이하게 하는 가장 좋은 방법은 환자를 다양한 머리 움직임에 노출시키는 방법이다. 머리 속도와 안구 속도의 차이는 오류 신호로 작용하여 망막상 이탈을 점진적으로 줄일 수 있다. 그러나 일부 연구자는 신경 기반의 동적 보상에 의문을 제기하였다. 대신 이 연구자들은 단속 안구운동과 같은 다른 안구운동 기전이 VOR 기능을 대체(substitution)함으로써 동적 보상이 달성된다고 제안하였다(Curthoys, 2000). 전정 보상에 대한 대체 개념에는 장점이 있지만, 회전의자검사에서 이득과 위상 매개변수의 변화와 같은 일부 결과를 설명하지는 못한다. 아마도 신경 변화와 대체의 조합이 동적 보상 과정을 설명하는 데 있어 더 나은 모델일 것이다. 흥미롭게도 목표가 적응이든 대체이든 상관없이 동일한 유형의 운동을 이용하여 동적 보상을 촉진할 수 있다.
COMPENSATION AFTER VERTICAL CANAL AND OTOLITH LESIONS
일측성 전정기능 손실 이후 대부분의 환자는 불균형감 및 그외 자세조절 결함을 나타낸다. 이러한 결함은 수직 반고리관이나 이석 기관의 기능 손실과 관련이 있을 가능성이 높다. 그러나 자세조절 결함은 안구운동 결함에 비해 더 빨리 해결되는 것으로 보인다. 아마도 정상측 미로의 나머지 기능을 자세조절 기전에 통합하는 것이 더 효율적일 것이다(Horak, 2010). 수직 반고리관의 병변이 안구운동에 미치는 영향은 앞서 설명한 수평 반고리관 병변의 영향과 유사하다(Aw et al., 1995). 유일한 차이점은 자발안진에 수직 및 회전성 성분을 모두 포함하고 있다는 점이다. 마찬가지로 정적 보상 과정도 앞서 설명된 것과 동일하다. 실제로 수직 및 회전성 안진에 대한 정적 보상은 수평 안진의 해결에 필요한 시간보다 적은 시간이 필요한 것으로 보인다. 수직 반고리관 병변의 동적 보상 과정에 대해서는 많이 알려져 있지 않지만 머리-안구 협응운동을 수직 반고리관 평면에서 수행하는 한 앞서 설명한 과정과 유사하다고 예상하는 것이 논리적이다.
앞서 언급했듯이, 이석 기관의 병변이 미치는 영향은 병변측 방향으로의 긴장성 안구 회전이 나타난다는 사실 외에 대해 알려진 것은 거의 없다(Curthoys, 2000). 시간이 경과함에 따라 안구 회전의 정도는 감소하는데 이는 자발안진의 소멸과 유사한 어느 정도의 보상 수준을 나타낸다(Furman et al., 2003). 그러나 안구 회전은 완전히 해결되지 않기 때문에 어떤 행태로든지 동적 보상이 필요함을 나타낸다(Curthoys et al., 1990). 이러한 견해로 판단할 경우 보상을 위해서는 이석 기관을 자극하는 머리 이행운동(translational head movement) 또는 편심 회전(eccentric rotation)과 같은 운동이 필요할 수 있다(Akin et al., 2013).
COMPENSATION AFTER BILATERAL VESTIBULAR LESIONS
양측 말초성 전정기능의 완전 손실에서는 신경 비대칭성이 발현되지 않기 때문에 일반적으로 정적 증상을 유발하지 않는다. 동시에 전정 입력의 완전한 손실로 인해 일측성 병변과 유사한 신경 행동의 변화에 기반한 동적 보상은 불가능하다(McCall & Yates, 2011). 이 경우 보상 과정은 누락된 전정계를 다른 감각 운동 기전으로 대체하는 것을 포함한다. 그러나 다른 감각 기전의 작동 주파수 범위의 차이로 인해 보상은 일반적으로 불완전하고 때로는 효율적이지 않다(Guinand et al., 2012). 예를 들어 목 수용체(neck receptor)는 머리 움직임에 대한 정보를 제공할 수 있지만, 작동 주파수 범위는 전정계에 비해 훨씬 낮다. 흥미롭게도 선천성 전정기능 손실 환자는 일반적인 사람들이 파악할 수 없을 정도의 장애 수준으로 기능할 수 있다. 가능하기는 하지만, 대부분의 후천성 양측 전정기능 손실 환자는 이 정도의 보상 수준까지 도달할 가능성은 거의 없다.
전정기능이 남아 있는 경우 보상 과정은 더 성공적일 것이다. 대체와 잔존 전정기능에 대한 의존이 결합될 경우 전정기능을 중간 수준 정도로 회복시킬 수 있다.
양측 전정기능 손실이지만 어느 한쪽 전정기능이 유의하게 더 저하된 환자의 경우에는 일측성 전정 병변에서 설명한 것과 동일한 유형의 정적 및 동적 보상 과정이 진행된다. 그러나 앞서 언급한 것과 같은 이유로 기능적 회복은 그다지 성공적이지 않을 가능성이 높다.
COMPENSATION AFTER CENTRAL VESTIBULAR LESIONS
중추성 이상은 현훈과 기타 평형 증상을 유발할 수 있다. 혈관성 병변 또는 두부 외상으로 유발되는 일부 중추성 이상은 중추 기관뿐 아니라 말초 전정경로에도 영향을 미칠 수 있다. 예를 들어 일부 동맥경색은 돌발성 청력 손실 및 전정기능 손실을 유발하는 것으로 알려져 있다. 이러한 병변의 경우, 말초성 이상에 대한 전정 보상은 앞서 설명한 방식처럼 진행될 수 있다. 그러나 중추성 보상 기전의 손상이 동시에 발생하였거나 또는 기존에 존재하고 있는 경우 기능적 회복은 어렵거나 불가능할 수 있다. 동물 연구에 따르면 소뇌 편엽(cerebellar flocculus)은 전정 보상에 중요한 부위로 확인되었다(Aleisa et al., 2007). 따라서 인간의 경우 소뇌 편엽 또는 그 주변부의 손상은 보상 과정에 유사한 악영향을 미칠 수 있다.
일반적으로 중추성 전정 병변은 말초성 전정 병변에 비해 전정 보상이 성공적이지 않다(Brown et al., 2006). 우선 중추성 전정 병변을 동반하고 있는 환자의 회복을 촉진하는 데 어떤 종류의 활동이 효과적인지 알려져 있지 않다.
CONCLUSIONS
정적 보상 과정은 일측성 전정미로의 구심성 신호 차단(unilateral vestibular deafferentation, UVD) 직후에 발생한다. 정적 보상 과정은 양측 전정 시스템 간의 긴장성 신경활동의 정적 균형을 복원하는 보상 기전으로 구성된다(McCaslin, 2013). 즉, 환자가 움직이지 않고 정지해 있을 경우 전정 말단 기관 사이의 비대칭성이 제거되고 전정성 자발안진(spontaneous vestibular nystagmus, SVN)도 발생하지 않는다. 앞서 설명한 것처럼, 각 전정신경은 많은 양의 신경활동을 전정핵으로 전달한다. UVD 이후 양측 전정핵 중 하나(손상된 미로와 연결된 전정핵)는 신경활동 입력을 받지 못하므로 양측 전정핵 사이에는 긴장성 신경 발화율의 비대칭이 발생한다. 양측 전정핵 간 신경 입력의 차이는 VOR을 작동시켜 “전정성 자발안진”으로 알려진 비정상적인 안진을 생성한다. 급성기일 경우 안진의 빠른 위상은 병측 귀 반대방향(건측 귀 방향)으로 박동한다. UVD가 발생한 후 수시간 이내 “cerebellar clamping” 현상이 시작된다(McCaslin, 2013).
소뇌는 양측 VN 사이의 긴장성 휴지기 발화율(resting rate)의 불균형에 빠르게 반응하여 병변 반대측(contralesional) VN의 긴장성 억제를 증가시킨다. 이러한 억제의 증가는 정상측 VN의 긴장성 휴지기 발화율을 감소시키는 역할을 하므로 양측 VN 간의 비대칭은 감소(또는 clamped)된다. 이 과정은 SVN의 진폭(현훈의 중증도 감소)뿐만 아니라 메스꺼움 및 창백과 같은 자율신경계 증상의 중증도도 감소시킨다. 이 시점에서 양측 VN의 긴장성 휴지기 신경 발화율은 손상 전 수준에 비해 감소한다. 실제로 환자에게 온도 자극 또는 회전 자극을 이용하여 검사를 실시하면 종종 양측 말초성 전정 손상과 일치하는 소견을 나타낸다. 병변 반대측(정상측) VN의 활동성이 감소된 경우 정적 보상 단계의 다음 단계가 시작된다. 정상적인 VOR의 성능을 회복하기 위해서는 양측 VN의 휴지기 신경 발화율을 손상 전인 원래 수준으로 되돌려야 한다. 첫째, 정상측의 cerebellar clamping 수준을 감소시켜야 한다. 이러한 작업을 수행하기 위해 소뇌는 VN과 직접적인 억제 연결을 통해 전송되는 신경 구동 수준을 감소시킨다. 이는 병변 반대측 VN의 긴장성 신경 발화율 레벨을 효과적으로 증가시키고(즉, 억제를 감소시킴), VN이 “clamped”된 상태를 해제한다. 둘째, 병변측의 긴장성 휴지기 발화율을 회복시켜야 한다. 보고에 따르면 병변측 VN의 휴지기 신경 발화율은 UVD 후 52시간 만에 손상 이전의 발화율과 동일해질 수 있다(Curthoys & Halmagyi, 1995; Curthoys & Halmagyi, 1996). 병변측 VN의 긴장성 발화율의 이러한 증가는 다양한 기원을 갖는 것으로 제안되었으며 주요 기원은 소뇌에서 매개되는 억제의 해제이다(Jacobson et al., 1998). 정적 보상 과정은 양측 VN의 휴지기 신경 발화율 평형을 이루면 완료된다. 이와 같이 병변측 신경활동의 증가 과정은 손상 전 신경활동 수준으로 돌아갈 때까지 계속되며, 동시에, 정상측의 소뇌 클램핑은 완전 정상 수준으로 돌아올 때까지 계속 감소한다. 이 시점에서 환자는 신경 비대칭성이 사라지고 머리가 정지되어 있는 한 증상은 더 이상 발현되지 않기 때문에 정적 보상을 달성한 것이다(Halmagyi et al., 2010).
정적 보상 과정 이후에도 VOR의 동적 반응 특성은 손상된 상태로 유지된다(McCaslin, 2013). 특히, 보상 기전은 머리 움직임 동안 손상된 기관이 적절한 신경 구동을 생성하지 못하는 점을 처리하기 위해 중추 전정계의 특성을 수정한다. 이 단계에서 양측 VN의 긴장성 휴지기 발화율은 동일하다. 그러나 머리를 움직일 경우 병변측 말초 전정계에서의 신경 입력은 거의 또는 전혀 증가하지 않는다. 이 시점에서 VOR 반응은 한쪽 미로에서의 신경 입력만 받으므로 동적 상황에서 정확한 보상적 안구운동을 제공할 수 없다. 동적 보상 과정은 한쪽 미로만으로도 VOR를 정확하게 구동할 수 있도록 전정계의 신경 출력을 조정하는 중추 구조로 구성된다.
동적 보상의 두 가지 주요 촉진자는 시각적 입력(Leigh & Zee, 2006)과 정중선 소뇌(Beraneck et al., 2008)이다. 이 두 시스템이 함께 UVD 후 VOR 기능 회복에 중요한 역할을 하는 것으로 나타났지만 다른 기여자도 있다(예: VN과 척추 입력 사이의 교련 섬유). 동적 기능을 완전히 회복시키는 이 과정의 능력은 손상의 중증도에 따라 달라진다. 완전 또는 중증 UVD에서는 종종 VOR 성능이 영구적으로 저하되며 대부분의 경우 저주파수 및 고주파수 모두에서 제대로 회복되지 않는다. 그러나 이런 환자들이 빠른 머리 회전 동안 진동시와 불안정성을 호소하지 않는 이유는 안구-머리 조정 전략을 새롭게 정교화하고 다른 트리거 신호(예: 단속적 대치)를 사용할 수 있기 때문이다. 예를 들어 신경 적분체는 속도저장 기전으로 유지되는 신경활동(저주파수)의 양을 감소시키고 보행 중 발생하는 주파수(고주파수)에 할당한다. UVD 이후 동적 보상 동안 발생하는 중추 전정계에 대한 이러한 조정은 종종 높은 가속도 및 저주파수 자극에 대한 민감도에서 VOR의 영구적인 이상을 초래한다(Barin & Durrant, 2000; Leigh & Zee, 2006).
때때로 과민성(irritative) 전정 장애(예: Menière disease) 환자에서 회복 안진(recovery nystagmus, RN)이라고 알려진 현상이 관찰된다. 이러한 형태의 자발안진은 “Bechterew’s” 안진이라고도 하며, 빠른 위상이 병변측 귀를 향해 박동하는 것을 특징으로 한다(Jacobson et al., 1998; Leigh & Zee, 2006). 임상적으로, RN은 병측 귀가 명확하게 확인된 경우 안진이 역설적인 방향(빠른 위상이 병측 귀를 향함)으로 박동하는 것처럼 보이기 때문에 해석하기 어려울 수 있다. 한쪽 내이의 균형 능력에 영향을 미치는 병변이 안정적인 경우 보상 기전은 매우 효과적이다. 그러나 손상된 전정계의 기능이 변동하는 경우 중추성 보상 기전은 그에 따라 조정되어야 한다. 이에 대한 예는 환자가 활동성 Ménière disease를 앓고 있는 경우이다. 메니에르병 발작 이후 급성기 동안 환자는 빠른 위상이 정상측 귀를 향해 박동하는 자발안진을 나타낸다. 양측 말초성 말단 전정기관 사이의 지속적인 신경 비대칭이 존재하게 되면 중추 신경계 보상 기전을 활성화시키고 이러한 비대칭성은 cerebellar clamping에 의해 감소된다. RN은 일반적으로 보상 기전의 “clamping” 단계 또는 양측 VN의 신경활동 수준이 모두 감소되어 있는 경우 가장 흔히 관찰된다. 이 단계의 보상 과정에서 손상된 쪽의 기능이 회복되면, 이번에는 반대 방향으로만 또 다른 긴장성 신경 비대칭성이 발생하게 된다. 정상측 전정핵의 긴장성 활동 수준이 감소되어 있음을 감안할 때, 이전에 병변측 귀의 기능 회복은 정상측 귀보다 병변측 귀의 긴장성 신경 출력을 높인다. 이러한 일련의 상황은 빠른 위상이 장애를 가졌었지만 회복 중인 귀 방향으로 박동하는 자발안진을 생성한다. 병변측 귀의 회복이 안정화된 환자는 정적 보상이 이루어져 RN은 사라지게 될 것이다. ENG/VNG 검사 중 해석의 오류를 예방하기 위해 임상가가 RN의 상황과 특성을 이해하는 것이 중요하다. 일부 질병의 불안정한 진행 특성과 중추신경계의 동적 보상 특성으로 인해 임상가는 병측 귀를 확인하기 위해 안진의 방향에 항상 의존할 수 없다.
전정 보상은 전정 병변 후 환자가 기능적 회복을 달성하는 과정이다. 전정 보상은 정적 보상을 달성하기 위해 전정핵의 긴장성 신경활동이 회복되고 동적 보상을 달성하기 위해 정상측 전정경로에 적응 변화가 일어나는 일측성 전정 병변에 가장 효과적이다. 다른 유형의 전정 병변에 대한 전정보상도 가능하지만 효과적이지는 않다. 전정 보상은 다음 조건이 충족될 때 가장 효과적으로 일어난다(McCaslin, 2013). 1. 환자가 전정억제제(vestibular suppressant)를 복용하지 않는 경우; 2. 환자가 자신의 머리를 움직일 경우(vestibular rehabilitation therapy의 기본 요소); 3. 환자가 정상적인 전정경로를 가지고 있는 경우; 4. 시력이 있는 환자
전정 병변의 재활 및 운동 요법에 대한 대부분의 연구는 일측 말초성 병변에 초점을 맞추어 왔다. 앞서 논의한 바와 같이, 일측 말초성 전정 병변 후 정적 보상은 대부분의 환자에서 자발적으로 발생한다. 그러나 물리치료와 운동 요법은 회복을 촉진시킬 수 있다. 동적 보상을 촉진하기 위한 가장 효과적인 접근법은 머리와 안구의 협응에 초점을 맞춘 운동인 것으로 보인다. 이러한 운동은 전정경로의 적응 또는 대체를 유발하는 데 필요한 오류 신호(망막상 이탈)를 중추 보상 기전에 제공한다(Herdman, 2013). 이러한 운동은 다양한 머리 속도와 다양한 운동 평면을 포함해야 한다. 또한, 상기 운동에는 전정 입력이 평형 조절 시스템 내에서 적절하게 통합될 수 있도록 시각, 고유수용성, 기타 감각 운동 기전을 포함해야 한다.
문헌 검토 결과에 따르면 실제로 앞서 설명한 운동 유형은 일측성 전정 병변의 재활 프로토콜의 일반적인 부분이다(Whitney & Sparto, 2011). 이러한 운동을 일반적으로 X1 및 X2 보기 운동(VOR x 1 and x 2 viewing exercises)이라고 한다.
양측 전정 병변에서도 동일한 유형의 머리-안구 협응 운동을 이용할 수 있다(Telian et al., 1991). 적응 효과는 유의하지 않을 수도 있지만 이러한 운동은 이러한 환자에서 누락되거나 감소된 전정기능의 대체를 촉진할 수 있다(Porciuncula et al., 2012). 예를 들어, X1 보기 운동 동안, 환자에게 정지되어 있는 목표물에 시고정을 한 상태에서 머리를 좌우로 움직이게 한다. 양측 전정 병변이 있는 환자에서 이러한 유형의 운동은 안구운동을 조절하기 위한 목 수용체의 사용을 촉진할 수 있다. 양측 전정 병변 환자에서 운동 요법의 성공률은 한쪽 전정 병변 환자 만큼 높지 않으며 종종 잔존 전정기능에 좌우되는 경우가 많다.
Acknowledgements
N/A
Notes
Ethical Statement
N/A
Declaration of Conflicting Interests
There are no conflict of interests.
Funding
N/A
